Sifat Kimia pada suatu zat atau bahan. Sifat kimia adalah karakteristik unik yang menentukan bagaimana suatu zat bereaksi dengan zat lain. Ini termasuk bagaimana suatu zat bereaksi dengan air, asam, atau basa, serta bagaimana zat tersebut membentuk ikatan kimia dengan zat lain. Sifat kimia ditentukan oleh konfigurasi elektron dan interaksi antarmolekul dalam suatu zat.
Contoh sifat kimia termasuk kelarutan, titik didih, titik leleh, keasaman, dan kebasaan.
Sifat kimia juga memegang peran penting dalam proses kimia seperti sintesis, penguraian, dan reaksi kimia. Sifat kimia membantu menentukan bagaimana suatu zat bereaksi dengan zat lain dan bagaimana hasil dari reaksi tersebut.
Mengerti sifat kimia suatu zat adalah penting untuk berbagai aplikasi, seperti pembuatan bahan kimia, farmasi, dan proses industri. Sifat kimia membantu memastikan bahwa proses kimia berlangsung secara aman dan memperoleh hasil yang diinginkan.
Apa yang dimaksud dengan sifat kimia suatu zat sebutkan contohnya?
Sifat kimia adalah karakteristik unik yang menentukan bagaimana suatu zat bereaksi dengan zat lain. Sifat kimia ditentukan oleh konfigurasi elektron dan interaksi antarmolekul dalam suatu zat.
Contoh sifat kimia:
- Reaksivitas: Kemampuan suatu zat bereaksi dengan zat lain.
- Kelarutan: Kemampuan suatu zat untuk terlarut dalam suatu pelarut.
- Titik didih/leleh: Suhu dimana suatu zat berubah dari cair menjadi padat atau sebaliknya.
- Keasaman/kebasaan: Kemampuan suatu zat untuk bertindak sebagai asam atau basa dalam reaksi kimia.
- Konduktivitas listrik: Kemampuan suatu zat untuk menghantarkan listrik.
- Sifat oksidasi/reduksi: Kemampuan suatu zat untuk bereaksi dengan oksigen dan membentuk oksida atau bereaksi dengan zat lain untuk membentuk reduksi.
a. Kestabilan suatu zat
Stabilitas adalah kemampuan suatu zat untuk mempertahankan kondisi dan sifatnya saat tidak ada pengaruh eksternal. Dalam kimia, stabilitas dapat didefinisikan sebagai kemampuan suatu zat untuk mempertahankan konfigurasi elektron dan interaksi antarmolekul yang membentuk suatu zat.
Stabilitas dapat dicapai dengan mencapai keseimbangan energi dan elektronik dalam suatu zat. Zat yang stabil memiliki energi yang rendah dan lebih sedikit tendensi untuk bereaksi dan mengubah sifatnya. Sebaliknya, zat yang tidak stabil cenderung memiliki energi yang tinggi dan lebih mudah bereaksi dan berubah.
Baca juga TEORI KEMAGNETAN BUMI KELAS 9
b. Reaktif suatu zat
Reaktivitas adalah kemampuan suatu zat untuk bereaksi dengan zat lain dan mengubah sifatnya. Reaktivitas ditentukan oleh konfigurasi elektron dan interaksi antarmolekul dalam suatu zat.
Zat yang memiliki elektron valensi yang tidak terisi secara stabil dan memiliki energi yang tinggi, cenderung lebih reaktif dan mudah bereaksi dengan zat lain. Sebaliknya, zat yang memiliki elektron valensi yang terisi dan memiliki energi yang rendah, cenderung lebih stabil dan kurang reaktif.
Contoh zat yang reaktif:
- Unsur-unsur golongan 1 dan 2 dalam tabel periodik (alkali dan alkali tanah)
- Gas mulia seperti helium, neon, dan argon
- Beberapa logam berat seperti natrium, kalium, dan magnesium.
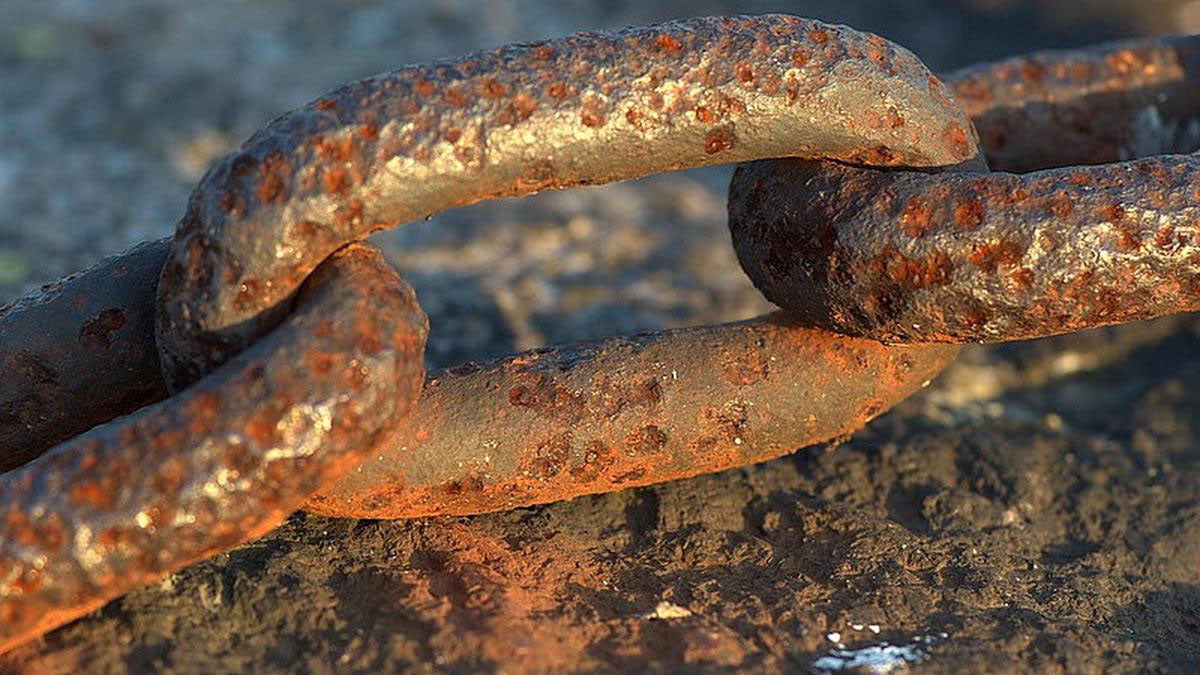
c. Korosifitas
Korosifitas adalah kemampuan suatu zat untuk mengkorosi atau membahayakan material lain dengan cara bereaksi dengannya. Korosifitas ditentukan oleh sifat kimia dan fisika dari suatu zat, serta kondisi lingkungan di sekitarnya.
Sifat Kimia pada suatu zat atau bahan. Beberapa faktor yang mempengaruhi korosifitas suatu zat meliputi keasaman, ketinggian suhu, tingkat kelembaban, dan keberadaan unsur-unsur lain seperti garam dan logam.
Contoh zat yang memiliki korosifitas tinggi:
- Asam sulfat
- Asam klorida
- Natrium hidroksida
- Kalium hidroksida.
Untuk mengurangi korosifitas, bahan-bahan ini sering dikombinasikan dengan bahan-bahan tahan korosi seperti logam berlapis atau cat anti korosi.

