Hukum Boyle Dan Contohnya: Memahami Hubungan Antara Volume Dan Tekanan Gas. Hukum Boyle, yang dinamai dari fisikawan Irlandia Robert Boyle, adalah hukum dasar dalam fisika yang menjelaskan hubungan antara volume dan tekanan gas. Hukum ini membantu kita memahami bagaimana perubahan volume suatu gas akan mempengaruhi tekanannya, dan sebaliknya. Dalam artikel ini, kita akan menjelajahi Hukum Boyle secara lebih mendalam, serta memberikan beberapa contoh yang menggambarkan penerapannya dalam kehidupan sehari-hari.
Pengertian Hukum Boyle
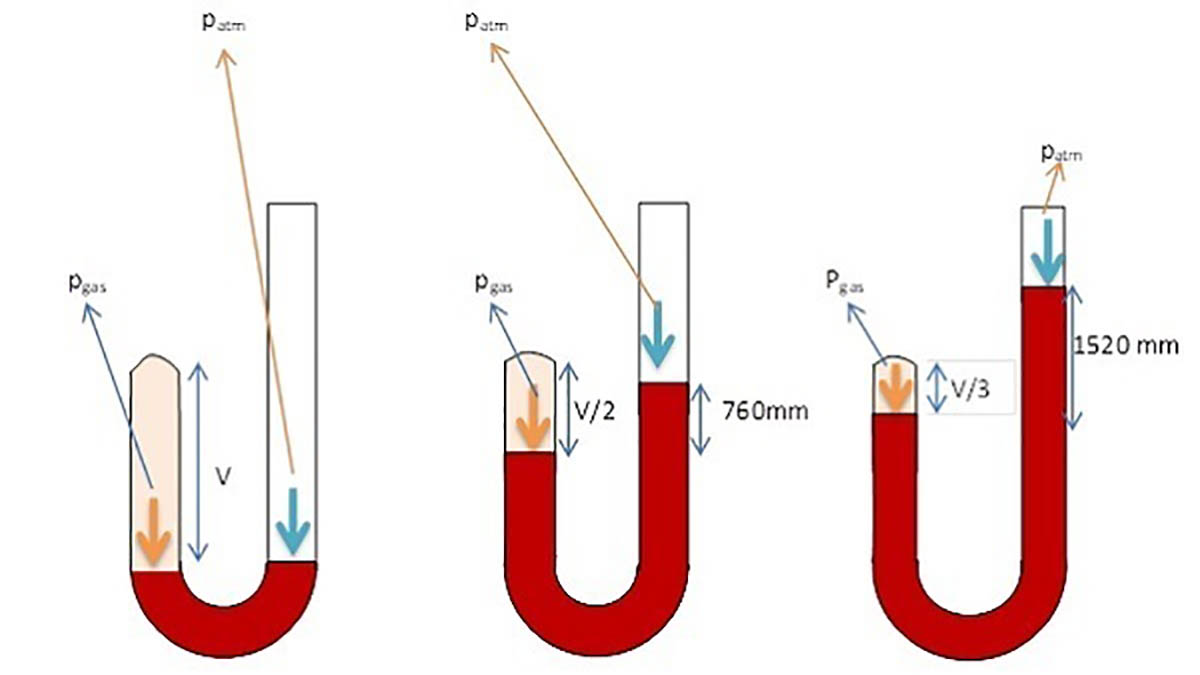
Hukum Boyle menyatakan bahwa pada suhu tetap, volume gas berbanding terbalik dengan tekanan gas yang diberikan padanya. Dalam kata lain, jika volume gas meningkat, maka tekanan gas akan menurun, dan sebaliknya, jika volume gas berkurang, maka tekanan gas akan meningkat.
Rumus matematis dari Hukum Boyle dapat dituliskan sebagai:
P1V1 = P2V2
Di mana P1 adalah tekanan awal gas, V1 adalah volume awal gas, P2 adalah tekanan akhir gas setelah perubahan volume, dan V2 adalah volume akhir gas setelah perubahan tekanan.
Contoh 1: Balon Udara
Salah satu contoh yang paling sederhana dan sering digunakan untuk menggambarkan Hukum Boyle adalah balon udara. Ketika balon udara ditiup, volume udara di dalam balon meningkat, sehingga tekanan udara di dalam balon menurun. Balon menjadi menggelembung dan mengembang ketika tekanan udara di dalamnya lebih rendah daripada tekanan udara di luar. Sebaliknya, ketika kita memperkecil volume udara di dalam balon dengan membuang sebagian udara, tekanan udara di dalam balon meningkat, menyebabkan balon menyusut.
Contoh 2: Sistem Pernapasan Manusia
Hukum Boyle juga dapat diterapkan dalam sistem pernapasan manusia. Ketika kita menghirup udara, rongga dada kita memperbesar volume, yang menghasilkan penurunan tekanan di dalam paru-paru. Akibatnya, udara di luar akan mengalir ke dalam paru-paru untuk menyeimbangkan tekanan. Ketika kita menghembuskan udara, volume rongga dada berkurang, sehingga tekanan di dalam paru-paru meningkat. Ini mengakibatkan udara di dalam paru-paru dikeluarkan ke luar.
Contoh 3: Scuba Diving
Dalam olahraga menyelam dengan tabung oksigen (scuba diving), Hukum Boyle juga berperan penting. Ketika seorang penyelam turun ke kedalaman, tekanan air di sekitarnya meningkat secara signifikan. Hal ini mengakibatkan tekanan gas di dalam tabung oksigen juga meningkat. Untuk menghindari ledakan tabung oksigen akibat tekanan yang berlebihan, tabung harus dirancang dengan kuat dan mampu menahan tekanan yang tinggi.
Contoh 4: Ban Sepeda
Hukum Boyle juga dapat diilustrasikan dalam konteks ban sepeda. Saat kita menggembungkan ban sepeda, volume udara di dalam ban meningkat, sehingga tekanan udara di dalam ban juga meningkat. Tekanan yang tinggi pada ban sepeda memberikan stabilitas dan kemampuan ban untuk menopang beban berat saat digunakan.
Baca juga MEKANISME MENDENGAR PADA MANUSIA DAN HEWAN
Kesimpulan
Hukum Boyle adalah hukum dasar dalam fisika yang menjelaskan hubungan antara volume dan tekanan gas. Pada suhu tetap, jika volume gas meningkat, maka tekanan gas akan menurun, dan sebaliknya. Hukum Boyle memiliki banyak penerapan dalam kehidupan sehari-hari, seperti dalam balon udara, sistem pernapasan manusia, scuba diving, dan ban sepeda. Memahami konsep Hukum Boyle memungkinkan kita untuk memahami perubahan volume dan tekanan gas, serta menerapkannya dalam berbagai konteks fisika dan aplikasi praktis.